A. RANCANGAN SINTESIS ASPIRIN
Pembahasan selanjutnya mengenai rancangan sintesis aspirin untuk mendapatkan rendemen yang tinggi. Sebelumnya, mari kita mengenal aspirin terlebih dahulu. Aspirin atau dikenal pula dengan asam asetilsalisilat (C9H8O2), juga termasuk dalam golongan fenol. Aspirin dapat disintesis dari asam asetat dengan asam salisilat dan menggunakan katalis asam ataupun melalui asam salisilat via asetilasi dengan anhidra asam asetat. Karakteristik dari senyawa ini tidak berbau, tidak berwarna, berbentuk kristal putih dengan berat molekulnya 180,16g/mol. Senyawa ini bisa dipakai sebagai NSAID/obat antiinflamasi. Sehingga tak heran jika senyawa ini tergolong analgesik yakni senyawa yang dimanfaatkan untuk mengurangi nyeri, sakit kepala, bahkan sebagai antipiretik dalam demam.
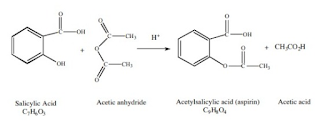
Rancangan desain sintesis aspirin yang dapat digunakan untuk menghasilkan rendemen yang tinggi yaitu dengan mereaksikan asam salisilat yang direaksikan terhadap anhidrida asam asetat berlebih, dan menggunakan asam kuat sebagai katalis. Hal ini karena dengan anhidrida asam asetat lebih reaktif dan reaksi dapat berlangsung cepat dengan produk yang diperoleh lebih banyak. Adapun reaksi yang terjadi yaitu :
Berikut ini langkah kerja dalam proses sintesis ini, yaitu :
1. Ditimbang 1 gram asam salisilat dan dimasukkan ke dalam erlenmeyer 50 ml.
2. Dalam lemari asam, dituangkan 30 ml anhidra asam asetat ke dalam erlenmeyer.
3. Ditambagkan 3 tetes asam fosfat pekat (85%) sebagai katalis reaksi dan dimasukkan batang pengaduk magnet ke dalam labu.
4. Dilakukan pemanasan sambil pengadukan dengan hotplate dan waterbath, seperti gambar di bawah ini

5. Dilakukan pemanasan pada suhu 1000C
selama 15 menit dan dimasukkan 3 ml air, lalu dinginkan dalam penangas es.
6. Ditambahkan 1 ml air deionisasi ke dalam labu. Air akan bereaksi dengan anhidrida asetat berlebih menjadi
asam asetat. Biarkan dalam lemari asam selama beberapa menit lagi.
7. Dihentikan pemanasan dan ditambahkan
9-10 ml air deionisasi ke dalam Erlenmeyer lalu diaduk dan dinginkan. Ketika
kristal aspirin mulai terbentuk dimasukkan labu kembali ke dalam penangas es
selama 10 menit.
8. Dikumpulkan kristal aspirin dengan filtrasi
vakum. Dimasukkan kertas saring pada corong Buchner lalu diletakkan pada sumbat
karet di Erlenmeyer. Berikut ini rangkaian alat filtrasi vakumnya

9. Dinyalakan aspirator air dengan kecepatan
penuh dan dibasahi kertas saring dengan sedikit air deionisasi. Diaduk Erlenmeyer
yang berisi aspirin dan saring. Dikerik kelebihan padatan pada Erlenmeyer dan
saring kembali. Selanjutnya, dituang 3 ml bilasan air dingin ke sampel untuk
membilas kembali, lalu dibilas padatan kembali dengan air dingin. Dibiarkan
pemasangan di tempat dengan aspirator menyala selama beberapa menit
10. Selanjutnya direkristalisasi aspirin
dengan menyisihkan sedikit aspirin mentah yang diperoleh.
11. Dipindahkan sisa aspirin mentah ke
dalam Erlenmeyer 50 ml, lalu ditambahkan 4 ml etanol dan dihangatkan labu di
atas hotplate sampai padatan larut. Selanjutnya, dikeluarkan Erlenmeyer dan
ditambahkan 13 ml air dingin secara perlahan dan kristal akan terbentuk.
Dinginkan kembali larutan dalam penangas es dan dikumpulkan kembal kristal
dengan filtrasi vakum.
12. Diangkat kertas saring dengan
kristal secara hati-hati dan diletakkan di atas kaca arloji bersih, lalu
dibiarkan sampai kering.
13. Ditimbang padatan yang diperoleh di
kertas saring.
14. Dilakukan pengujian kemurnian
aspirin dengan menggunakan pengujian titik leleh (sampel harus kering). Di mana titik leleh aspirin murni adalah 135°C
dan titik leleh asam salisilat adalah 158°C
15. Dilakukan pengujian dengan FeCl3
(sampel tidak harus kering) dengan mengambil 4 tabung reaksi, lalu dimasukkan 1
ml etanol dan 2 tetes FeCl3 dalam masing-masing tabung reaksi. Selanjutnya,
ditambahkan kristal asam salisilat pada tabung pertama, aspirin mentah pada
tabung kedua, kristal aspirin yang direksristalisasi pada tabung ketiga, dan
tabung keempat tidak ditambahkan apa pun. Lalu, dikocok masing-masing tabung.
B. RANCANGAN SINTESIS ASAM SINAMAT

Pembahasan selanjutnya mengenai rancangan sintesis asam sinamat untuk mendapatkan rendemen yang tinggi. Sebelumnya, mari kita mengenal asam sinamat itu sendiri. Asam sinamat atau cinnamic acid (C9H8O2) ialah suatu jenis asam yang masuk golongan fenol dan terbuat dari bahan dasar fenilalanin juga tirosin. Asam sinamat berguna dalam bidang pengobatan, parfum, polimer, kosmetik bahkan pertanian. Sintesis asam sinamat dilakukan dengan berbagai metode, yaitu reaksi Knoevenagel, Perkin, Pechman, Reformatsky, dan Wittig.
Di pembahasan ini akan membicarakan mengenai metode yang memberikan rendemen asam sinamat yang tinggi. Di mana dari beberapa metode tersebut, metode yang sederhana dan paling efisien adalah reaksi kondensasi Knoevenagel melalui dietilmalonat dengan benzaldehida menggunakan katalis oleh campuran oksida Mg/Al, Mg-Al + Ln ( di mana Ln = Dy, Gd), atau Li/Al. Berikut reaksinya :
Dalam prosesnya, pemanasan juga sangat berguna untuk mempercepat laju reaksi yang berlangsung, sehingga dapat meningkatkan selektivitas dan bebas pelarut. Di bawah ini diberikan reaksi sintesis asam sinamat dengan bantuan gelombang mikro dalam waktu 90 detik dan melibatkan pencampuran 1 mM benzaldehida dengan 2 mM asam malonat dan 0,3 gram polifosfat ester (PPE) selama 3-4 menit.
Berikut ini diberikan rancangan sintesis asam sinamat yang sederhana dengan metode kondensasi Knoevenagel dengan memakai katalis DABCO, yaitu :
1. Siapkan aldehida aromatik (500 mg, 1.0 equiv) dan asam malonat (981 mg, 2.0 equiv)
2. Ditambahkan DABCO sebagai katalis (105 mg, 2 equiv)) dalam dimetil formamida sebanyak 5 ml. DABCO ialah suatu molekul dizabisklik yang memiliki hambatan sedang dan sering dipakai dalam proses sintesis senyawa organik dengan perannya sebagai basa lemah dan ligan. Digunakannya katalis ini karena salah satu katalis basa lemah, murah, tidak beracun, cukup reaktif, dan mampu menghasilkan senyawa produk dengan rendemen tinggi dengan selektivitasnya yang tinggi.
3. Dicampurkan senyawa, dipanaskan dan diaduk pada suhu 100-110°C selama 60-90 menit.
4. Setelah reaksi selesai (pemantauan KLT), campuran reaksi dituangkan dalam air dan kemudian diekstraksi dengan etil asetat.
5. Produk mentah direkristalisasi dari sistem kloroform/heksana untuk menghasilkan asam sinamat dengan rendemen yang baik.
Dari hasil reaksi, dengan asam malonat reaksinya menghasilkan pembentukan asam trans-sinamat tersubstitusi, berikut skemanya :
Dalam reaksi ini bila kita lakukan pada suhu kamar maka membutuhkan waktu yang sangat amat panjang, yaitu 22-24 jam, namun jika kita memakai refluks hanya membutuhkan 60-90 menit saja. Berikut ini diberikan tabel substrat dan produk yang dihasilakan beserta lama reaksi dan %rendemen yang dihasilkan :
Dalam reaksi ini, pelarut DMF memberikan hasil produk yang lebih tinggi dengan waktu reaksi yang lebih sebentar dari pelarut lainnya. Berikut tabel perbandingan waktu dan %rendemen yang dihasilkan :
Dari reaksi ini, ada beberapa keuntungan yang diperoleh yaitu tidak memerlukan netralisasi, dan pemurnian lebih lanjut, serta reaksi ini dapat dilakukan di bawah kondisi rendah. Berikut ini tabel hasil yang diperoleh melalui reaksi ini :
PERMASALAHAN :
1. Mengapa anhidrida asam asetat jauh lebih banyak dipilih daripada asam asetat dalam sintesis aspirin?
2. Apakah proses filtrasi vakum dapat digantikan dengan proses filtrasi biasa dalan sintesis aspirin?
3. Apa saja faktor pendukung dalam rancangan sintesis asam sinamat ini?
Berikut ini link YouTube pembahasan materi ini : https://youtu.be/Dz2OLt4MmrE








Baiklah saya Marwina Apriyanti (A1C119017) Izin menjawab permasalahan nomor 1. Anhidrida asam asetat lebih banyak dipilih sebab jauh lebih aman, lebih reaktif, murah dan tidak mudah mengalami hidrolisis selama proses sintesis berlangsung dan menghasilkan produk yang lebih banyak.
BalasHapusBaiklah, terimakasih atas jawabannya, disini saya ingin menyanggah.
HapusApa yang membedakan anhidrida asam asetat dengan asam asetat sehingga dapat dinyatakan bahwa produk yang dihasilkan pada anhidrida asam asetat lebih banyak? Bukankah perbedaan dari kedua senyawa ini hanya salah satu senyawa adalah senyawa anhidrida?
baik saya Marwina Apriyanti (A1C119017) Izin menjawab sanggahan dari Suci. Pembeda dari kedua senyawa ini adalah kereaktifannya. Apabila kita menggunakan asam asetat, reaksi yang terjadi akan berlangsung lambat sehingga membutuhkan waktu yang lama dan karena sifatnya yang kurang reaktif sehingga produk yang dihasilkan lebih sedikit daripada saat menggunakan asam anhidrida asetat. Sedangkan ketika kita menggunakan asam anhidrida asetat yang lebih reaktif akan memerlukan waktu reaksi yang lebih cepat dan produk yang dapat kita hasilkan jauh lebih banyak. Sifatnya yang anhidrida maka akan lebih mudah dalam menyerap air sebagai produk samping sehingga akan sangat membantu dalam proses rekristalisasi produk aspirin.
HapusBaiklah saya Erina Shafura (A1C119068), Izin menjawab permasalahan Suci no. adapun faktor-faktor-faktor pendukung dalam sintesis aspirin dan asam sinamat ini adalah Suhu dan lama waktu pemanasan, jumlah pereaksi yang digunakan, katalis dan pelarut. Di mana untuk mendapatkan hasil yang baik dengan rendemen yang tinggi, maka seluruh faktor pendukung tersebut harus dalam keadaan optimal.
BalasHapusBaiklah, terimakasih atas jawabannya, disini saya ingin menyanggah.
HapusApabila suhu dan lama waktu pemanasan sebagai salah satu faktor yang mempengaruhi, apakah hasil yang diperoleh akan sama baiknya apabila digunakan suhu di bawah 100°C dan waktu pemanasan kurang dari 60 menit?
Baik izin menjawab dalam hal ini suhu dan lama pemanasan menjadi salah satu faktor yang mempengaruhi dalam proses sintesis asam sianamat agar diperoleh rendemen yang tinggi, maka apabila salah satu faktornya diubah dalam kondisi yang tidak optimal maka hasil yang diperoleh tidak akan sama baik/tidak optimal seperti kondisi yang seharusnya. Apabila suhu yang digunakan di bawah 100°C, maka pemanasan tidak akan berlangsung dengan merata dan reaksi akan berjalan lambat, karena suhu tersebut adalah suhu optimal bagi sampel untuk bereaksi. Karena suhu yang digunakan di bawah suhu optimal sehingga memerlukan waktu yang lebih lama untuk bereaksi, sedangkan waktu pemanasan yang digunakan kurang dari lama pemanasan optimum maka hasil yang diperoleh tentu sangat tidak optimal. Karena tidak semua sampel yang tersedia bereaksi dengan sempurna dan asam sinamat yang diperoleh tentu memiliki rendemen yang rendah. Dengan begitu, untuk memperoleh hasil yang maksimal semua faktor pendukung harus dalam keadaan optimal.
HapusBaiklah saya gadis septyo wulandari izinmenjawab permasalahan nomor 2.
BalasHapusDapat saja filtrasi vakum digantikan dengan proses filtrasi biasa, namun perlu diketahui hasil yang diperoleh tidak akan maksimal seperti filtrasi vakum.
Baiklah, terimakasih atas jawabannya, disini saya ingin menyanggah.
HapusMengapa hasil yang diperoleh dapat dikatakan tidak maksimal? Bukankah tujuan dari kedua filtrasi tersebut sama-sama untuk menghilangkan pengotor dari senyawa dan mendapatkan padatan aspirin?
Baiklah izin menjawab.
HapusAlasannya produk yang dihasilkan lebih maksimal dengan filtrasi vakum karena dengan filtrasi vakum sampel akan dengan teliti dipisahkan dari pengotor dan prosesnya akan berlangsung dengan cepat, karena disertai dengan proses pengeringan dan penyedotan air/pengotor secara langsung di mana padatan aspirin akan segera terbentuk, sedangkan dengan filtrasi biasa ketelitiannya jauh lebih rendah dari filtrasi vakum, terlebih membutuhkan ketelitian yang besar dan seringkali pengotor masih terdapat pada produk yang diinginkan, sehingga hasil yang diperoleh tidak maksimal.